
כל תוכן iLive נבדק מבחינה רפואית או נבדק למעשה כדי להבטיח דיוק עובדתי רב ככל האפשר.
יש לנו קווים מנחים קפדניים המקור רק קישור לאתרים מדיה מכובד, מוסדות מחקר אקדמי, בכל עת אפשרי, עמיתים מבחינה רפואית מחקרים. שים לב שהמספרים בסוגריים ([1], [2] וכו ') הם קישורים הניתנים ללחיצה למחקרים אלה.
אם אתה סבור שתוכן כלשהו שלנו אינו מדויק, לא עדכני או מפוקפק אחרת, בחר אותו ולחץ על Ctrl + Enter.
נניזם של בלוטת יותרת המוח (גמד)
המומחה הרפואי של המאמר
סקירה אחרונה: 12.07.2025
המונח "גמדות בלוטת יותרת המוח" (מהמילה היוונית ננו - גמד; סינתזה: גמדות, ננוזומיה, מיקרוסומיה) במובן המוחלט פירושו מחלה, שהביטוי העיקרי שלה הוא פיגור חד בגדילה, הקשור להפרעה בהפרשת הורמון הגדילה על ידי בלוטת יותרת המוח הקדמית.
במובן רחב יותר, גמדות היא הפרעה של גדילה והתפתחות גופנית, אשר הופעתה יכולה להיגרם לא רק עקב מחסור מוחלט או יחסי בהורמון סומטוטרופי עקב פתולוגיה של בלוטת יותרת המוח עצמה, אלא גם עקב הפרעה בוויסות ההיפותלמוס (המוחי) של תפקודיה, פגמים בביוסינתזה של הורמון סומטוטרופי והפרעות ברגישות רקמות להורמון זה.
גורם ל גמדות
רוב צורות הגמדות של בלוטת יותרת המוח הן מחלות גנטיות. הנפוצה ביותר היא גמדות פאנהיפופיטויטירית, אשר עוברת בתורשה בעיקר באופן רצסיבי. ההנחה היא שישנם שני סוגים של העברה של צורת פתולוגיה זו - אוטוזומלית ודרך כרומוזום X. בצורה זו של גמדות, יחד עם הפגם בהפרשת הורמון סומטוטרופי, הפרשת הגונדוטרופינים והורמון מגרה בלוטת התריס מופרעת לרוב. הפרשת ACTH מופרעת בתדירות נמוכה יותר ובמידה פחותה. מחקרים פונקציונליים עם הורמונים משחררים, כולל הורמון משחרר סומטוטרופינים סינתטי (המורכב מ-29, 40 ו-44 שיירי חומצות אמינו), בדומה לפוליפפטיד בלבלב, הראו שלרוב החולים הללו יש פתולוגיה ברמת ההיפותלמוס, ואי ספיקה של בלוטת יותרת המוח הקדמית היא משנית. פתולוגיה ראשונית של בלוטת יותרת המוח עצמה פחות שכיחה.
גמדות גנטית עם חסר בודד בהורמון גדילה, עם פעילות ביולוגית לקויה ורגישות אליו, נתקלת באופן ספורדי ברוסיה ובמדינות שכנות. היא שכיחה יותר ביבשת אמריקה, במדינות המזרח הקרוב והמזרח התיכון ובאפריקה. בהתבסס על תוצאות מחקר על תכולת ההורמון הסומטוטרופי בדם ורגישות החולים להורמון הסומטוטרופי אקסוגני, רמת האינסולין האימונו-ריאקטיבי (IRI), גורמי גדילה דמויי אינסולין (IGF) מסוג I (סומטומדין C) וסוג II, ותגובת IGF-1 לטיפול בתכשירים של הורמונים סומטוטרופיים, זוהו וריאנטים שונים של סוגים דומים קלינית של גמדות.
לאחרונה פוענחה הפתוגנזה של גמדות לרון, הנגרמת עקב מחסור ב-IRF-1 ו-IRF-II, כמו גם הפתוגנזה של גמדות אצל פיגמים אפריקאים, הקשורה לחסר בראשון.
בשנת 1984 תוארה גרסה חדשה של גמדות פסאודו-יותרת המוח עם רמה גבוהה של הורמון סומטוטרופי ו-IGF-1; מקור הגמדות מוסבר על ידי פגם בקולטנים שלו, המוכח על ידי ירידה חדה בקישור של פיברובלסטים בעור ל-IGF-1.
יש להדגיש כי בתנאים מודרניים, עם נוכחות של משפחות קטנות, מקרים בודדים רבים ("אידיופתיים", ספורדיים) של המחלה יכולים להיות גם גנטיים.
בניתוח של 350 תיאורי מקרה, האטיולוגיה של גמדות לא הייתה ברורה ב-228 חולים (65.2%). קבוצה זו כללה חולים מ-57 משפחות עם שכיחות חוזרת של גמדות (2-4 מקרים למשפחה), שהיוו 28% מכלל החולים. ב-77% מהמשפחות עם צורות גמדות לא ברורות מבחינה אטיולוגית (בעיקר גנטיות), נקבע קשר שאין להכחשה עם תורשת היעדר גורם Rh. התפלגות גורם Rh במשפחות של חולים עם גמדות שונה מזו שנצפתה בקונפליקט Rh בין האם לעובר, וככלל, אינה מלווה במחלה המוליטית של הילוד (האב עשוי להיות Rh שלילי, ובמקרה של הטרוזיגוטיות של ההורים לגורם Rh - ילדים וכו'). ניתן להניח קשר בין פעילות הגנים האחראים לסינתזה של הורמון סומטוטרופי (או הורמון משחרר סומטוטרופין) לבין גנים הקובעים את גורם Rh, במיוחד מכיוון שרוב צורות הגמדות והיעדר גורם Rh הן תכונות אוטוזומליות רצסיביות. אין בכך כדי להסביר את הנדירות היחסית של גמדות בהשוואה לתדירותם של אנשים בעלי Rh-שלילי באוכלוסייה. סביר להניח שכמה גורמים נוספים שעדיין לא ידועים חשובים, אך מאפייני התפלגות גורם ה-Rh במשפחות של חולים עם גמדות משפחתית וספורדית אינם צפויים להיות מקריים.
קבוצה גדולה של חולות עם גמדות (מוחית ראשונית, מוחית-יותרת המוח) הן חולות עם סוגים שונים של פתולוגיה אורגנית של מערכת העצבים המרכזית שהתפתחה ברחם או בילדות המוקדמת. המצע האנטומי הגורם לפתולוגיה זו עשוי להיות תת-התפתחות או היעדר בלוטת יותרת המוח, דיסטופיה שלה בפתולוגיה של היווצרות הסלה טורצ'יקה, ניוון ציסטי של בלוטת יותרת המוח, ניוון שלה עקב דחיסה על ידי גידול (קרניופרינגיומה, אדנומה כרומופובית, מנינגיומה, גליומה). גמדות יכולה להיגרם מפגיעות טראומטיות באזור ההיפותלמוס-יותרת המוח (תוך רחמי, בלידה או לאחר לידה), שלעתים קרובות מתרחשת בהריונות מרובי עוברים, כמו גם במהלך לידה בעכוז, במצג כף הרגל או במנח רוחבי עם סיבוב על הרגל (זהו מנגנון הלידה ביותר מ-1/3 מהחולות עם גמדות). נזקים זיהומיים ורעילים הם חשובים (זיהומים ויראליים תוך רחמיים, שחפת, עגבת, מלריה, טוקסופלזמוזיס; מחלות בגיל צעיר, אלח דם בילודים, דלקת קרום המוח והארכנואנצפליטיס וכו'). תהליכים אלה עלולים לפגוע בבלוטת יותרת המוח עצמה, במרכזים ההיפותלמוסיים המווסתים את תפקודה, ולשבש קשרים תפקודיים תקינים במערכת העצבים המרכזית.
נגעים תוך רחמיים בעובר עלולים להוביל ללידת חולות עם "גמד מלידה" עם הפרשה תקינה של הורמון גדילה (גמד מוחי ראשוני, מיקרוצפליה, גמד סילבר-ראסל עם המי-אסימטריה בגוף ורמות גבוהות של גונדוטרופינים וכו').
גורמים נוספים המחמירים את הפגיעה בהתפתחות הפיזית בגמדים עשויים להיות תזונה לקויה, לא מאוזנת מבחינת מרכיבים חיוניים (מחסור בחלבון) ומיקרו-אלמנטים (מחסור באבץ), ותנאים סביבתיים קשים, כמו גם מחלות כרוניות שונות, כגון גלומרולונפריטיס, שבה אזוטמיה משפיעה על פעילות קולטני הכבד או משפיעה ישירות על חילוף החומרים של תאי הכבד, מה שגורם לירידה בסינתזה של סומטומדין, או שחמת הכבד, כאשר היווצרות הסומטומדין נפגעת.
פתוגנזה
ברוב החולים עם גמדיות בלוטת יותרת המוח, השינויים אינם מוגבלים לפתולוגיה של הפרשת הורמון סומטוסטרופי ורגישות אליו, אלא משתרעים על הורמונים טרופיים אחרים של בלוטת יותרת המוח, מה שגורם לשילובים שונים של הפרעות אנדוקריניות ומטבוליות.
בחסר בודד בהורמון סומטוסטרופי, שינויים מורפולוגיים בבלוטת יותרת המוח נחקרו בצורה גרועה. במקרים שנחקרו, נמצאו הפרעות פתולוגיות לעיתים רחוקות (קרניופרינגיומה או היפרוסטוזיס של עצמות הגולגולת). בסוג זה של גמדות, ניתן לראות תת-התפתחות מולדת של תאים פפטידרגיים או פגם במערכת הנוירוטרנסמיטרים בהיפותלמוס. במקרים כאלה, גמדות עשויה להיות משולבת עם דיספלזיה או היפופלזיה של עצבי הראייה. ציסטות תוך-סלריות, גידולים של בלוטת יותרת המוח וההיפותלמוס מובילים לחסר ב-STH, הגורם לדחיסה של רקמת יותרת המוח, בפרט סומטוסטרופים.
גמדות מאופיינת בהידלדלות העצמות, בעיקר עקב שכבת קליפת המוח, התמיינות מאוחרת ואוסיפיקציה של השלד. האיברים הפנימיים היפופלסטיים, לעיתים אטרופיים, והשרירים מפותחים בצורה גרועה.
תסמינים גמדות
פיגור חד בגדילה ובהתפתחות הפיזית הם הביטויים העיקריים של גמדות בלוטת יותרת המוח. חולים נולדים עם משקל ואורך גוף תקינים ומתחילים לפגר בגדילה מגיל 2-4 שנים.
לפני הופעת הטיפול הפעיל בנניזם, ננסים נחשבו לאלו שגובהם נמוך מ-120 ס"מ לנשים ו-130 ס"מ לגברים. כיום, גובהו של ננס שונה בלפחות 2-3 סטיות סיגמא מהנורמה הטבלאית הממוצעת עבור מין, גיל או אוכלוסייה נתונה. קיימת גם שיטה להערכה גרפית של גובה המבוססת על עקומת ההתפלגות גאוסית. במקרה זה, ננסים לפי גובה נכללים בקבוצה הכוללת את המספר המינימלי של פרטים באוכלוסייה המתאימה עם הפיגור הגדול ביותר מנורמת הגדילה הממוצעת.
גמדיות בלוטת יותרת המוח מאופיינת לא רק בגודל גוף מוחלט קטן, אלא גם בדינמיקה קטנה של גדילה שנתית והתפתחות גופנית. מבנה הגוף פרופורציונלי, אך פרופורציות גופם של החולים אופייניות לילדות. העור חיוור, לרוב עם גוון צהבהב, יבש, הנובע מאי ספיקת בלוטת התריס המוחלטת או היחסית, לעיתים נצפית ציאנוזיס - "שיש" של העור. בחולים שלא טופלו, מופיע מוקדם עור בעל מראה ישן ומקומט (גרודרמה). זאת בשל חוסר פעילות אנבולית של STH ושינוי איטי של דורות תאים.
שיער על הראש יכול להיות רגיל או יבש, דק, שביר; ריסים ארוכים אופייניים. צמיחת שיער משנית נעדרת לעיתים קרובות. גודל הסלה הטורצ'יקה אצל רוב החולים עם גמדות (70-75%) לא משתנה, אך הסלה שומרת לעתים קרובות על צורתה הילדותית של "אליפסה עומדת", בעלת גב רחב "ילדותי", הסינוס של עצם הספנואיד מפגר מאחור מבחינת פנאומטיזציה. עם זאת, ישנם חולים עם סלה טורצ'יקה מוגדלת, שהיא סימן לגידול; עם אזורי הסתיידות על רקע או באזור הכניסה (עם קרניופארינגיומה, השפעות שיוריות של נוירו-זיהום) או הקטנה שלה (סימנים של חוסר התפתחות, גודל קטן של בלוטת יותרת המוח). נצפים תסמינים של יתר לחץ דם תוך גולגולתי: דילול עצמות קמרון הגולגולת, דפוס כלי דם מוגבר, נוכחות של טביעות אצבעות וכו'. הסימן החשוב ביותר לגמדות של בלוטת יותרת המוח הוא עיכוב בעיתוי ההתמיינות וההתאבנות של השלד. מאפייני מערכת השיניים קשורים קשר הדוק גם להתמיינות השלד: נצפית החלפה מאוחרת של שיני חלב. העיכוב הגדול ביותר בהתפתחות מערכת השלד נצפה בחולים עם גמדות עם אי ספיקה מינית ותת-פעילות של בלוטת התריס.
איברי המין של רוב החולים אינם מפותחים מספיק, אם כי מומים הם נדירים. נצפה קריפטורכידיזם ב-5.8% מהחולים הגברים. אי ספיקה מינית מלווה בחוסר התפתחות של מאפיינים מיניים משניים וירידה בחשק המיני, היעדר וסת. התפתחות מינית ספונטנית תקינה נצפית רק בחולים עם חסר בודד בהורמון גדילה ובחלק מהחולים עם גמד מוחי.
אי ספיקה של בלוטת התריס היא תסמין שכיח למדי של גמדות. יש לציין כי הביטויים החיצוניים של תת פעילות של בלוטת התריס אינם תמיד משקפים את המצב התפקודי האמיתי של בלוטת התריס. זאת בשל תת פעילות של בלוטת התריס יחסית עקב הפרעה במעבר של תירוקסין (T4 ) לטרייודותירונין (T3 ) ויצירת T3 לא פעיל (הפיך) , האופייני לאי ספיקה סומטוסטרופית.
תפקוד האדרנוקורטיקוטרופי בגמדיות בלוטת יותרת המוח יורד בתדירות נמוכה יותר ובמידה פחותה מאשר תפקודי המין ותירואיד המגרה, וברוב החולים אינו דורש תיקון מיוחד.
ברוב המקרים, האינטלקט אינו נפגע. שינויים רגשיים בצורת אינפנטיליזם מנטלי נצפים; אצל חולים מבוגרים ללא פגיעה שכלית, לעיתים נצפות נוירוזות ריאקטיביות.
בפתולוגיה מוחית אורגנית, במיוחד בעלת אופי גידולי, גמדות יכולה להתרחש עם תסמינים של סוכרת תפלה, המיאנופסיה ביטמפורלית וליקויים שכליים.
מחקר על התפתחות הפעילות הביו-אלקטרית של המוח בחולים ללא תסמינים אורגניים של מערכת העצבים המרכזית הראה כי ה-EEG שלהם מאופיין בתכונות של חוסר בגרות, שימור ארוך טווח של מתח EEG "ילדותי" גבוה; חוסר אחידות של קצב אלפא במשרעת ובתדירות; עלייה חדה בתוכן של קצב θ ו-δ איטי, במיוחד במקטעים הקדמיים והמרכזיים; תגובה ברורה להיפר-ונטילציה; שינוי בטווח קצבי ה-EEG בעקבות קצב גירוי האור לכיוון תדרים נמוכים (עדות לירידה בניידות התפקודית של מבני העצבים של המוח). התגלה כי בחולים מבוגרים יותר, האופי הלא בוגר של הפעילות החשמלית של המוח נובע מתת-התפתחות מינית, ובחולים בכל קבוצות הגיל - תת-פעילות של בלוטת התריס.
מטבוליזם של פחמימות בחולים עם גמדות מאופיין בנטייה לירידה ברמות הגלוקוז בדם בצום, עלייה במהלך מאמץ פיזי, חוסר באינסולין אנדוגני, רגישות מוגברת לאינסולין אקסוגני עם התפתחות תכופה של מצבים היפוגליקמיים. האחרון מוסבר בעיקר על ידי רמות לא מספקות של הורמונים אנטי-אינסולריים בגוף החולים.
איברים פנימיים מראים ספלנקנומיקריה, כלומר, ירידה בגודלם. לא תוארו שינויים תפקודיים באיברים פנימיים ספציפיים לגמדות. לעיתים נצפים לחץ דם עורקי נמוך עם ירידה בלחץ סיסטולי ודיאסטולי וירידה באמפליטודת הדופק. צלילי הלב עמומים, נשמעים אוושות תפקודיות בנושאים שונים עקב שינויים טרופיים בשריר הלב והפרעות אוטונומיות. א.ק.ג. מאופיין במתח נמוך (במיוחד בנוכחות תת פעילות של בלוטת התריס), ברדיקרדיה בסינוסים או ברדיאריתמיה; א.ק.ג. מראה ירידה באמפליטודת הטונים, טונים נוספים ואושות תפקודיות. נתוני אוקסיגומטריה מצביעים על היפוקסמיה (בהתחלה ובמהלך מאמץ פיזי) וחוב חמצן. חולים קשישים מפתחים לעיתים יתר לחץ דם.
אבחון גמדות
האבחון והאבחנה המבדלת של גמדות מבוססים על נתוני אנמנזה ובדיקה קלינית, רדיולוגית, מעבדתית והורמונלית מקיפה. בנוסף לגודל הגוף המוחלט, כדי להעריך את גדילת החולים, נקבע גירעון גדילה - ההפרש בין גובה המטופל לנורמה הממוצעת שלו למין ולגיל המתאימים; גיל גדילה - עמידת גובה המטופל בסטנדרטים מסוימים; אינדיקטור לסטייה מנורמלת.
I = M - Mcp / δ, כאשר M הוא גובה המטופל, Mcp הוא הגובה הנורמלי הממוצע למגדר וגיל נתונים, δ הוא הסטייה הריבועית מ-Mcp; I קטן מ-3 אופייני לנאניזם, I גדול מ-3 אופייני לג'יגנטיות. ניתן להשתמש במדד זה כדי להעריך את הדינמיקה של ההתפתחות.
בדיקת רנטגן של חולים עם גמדות מגלה סימנים של יתר לחץ דם תוך גולגולתי, השפעות שיוריות של זיהום עצבי, הסתיידויות וקרניוסינוסטוזיס. מחקר הגודל, הצורה והמבנה של הסלה טורצ'יקה נחשב למדד עקיף המאפיין את גודל בלוטת יותרת המוח. אחד הביטויים החשובים ביותר של פיגור בגדילה פתולוגי הוא הפרה של התמיינות השלד. כדי להעריך את מידת בגרות השלד, נקבע גיל העצם (רדיוגרפי), התואם להתמיינות רקמת העצם; חוסר אוסיפיקציה הוא מידת הפיגור של אוסיפיקציה מהנורמה (בשנים), מקדם אוסיפיקציה הוא מנת חלוקת גיל העצם על ידי פרמטרים כרונולוגיים ואחרים.
אבחון מודרני של גמדות אינו אפשרי ללא לימוד הפרשת ההורמון הסומטוטרופי, רמתו הבסיסית, קצב היממה ושחרורו תחת גירוי. רוב החולים עם גמדות בלוטת יותרת המוח מאופיינים בתכולה מופחתת של הורמון סומטוטרופי בסרום הדם. כאשר נקבע בשיטה הרדיואימונולוגית, הוא (על פי מחברים שונים) בין (0.87±0.09) ל- (1.50±0.64) ng/ml, עם נורמה ממוצעת של (3.81±0.29) ng/ml. מחקר של קצב יומי (צירקדי) של הפרשת הורמון סומטוטרופי הראה שרמתו אצל אנשים בריאים היא מקסימלית במהלך שעתיים ראשונות של שינה ובשעה 4-6 בבוקר. בגמדות, תכולת ההורמון הסומטוטרופי מופחתת גם בשעות אלה.
כדי לחקור את עתודות התפקוד הסומטוטרופי, משתמשים בחומרים ממריצים שונים, תוך בדיקת תכולת ההורמון הסומטוטרופי לפני ואחרי הכנסתם. דם למחקר נלקח כל 30 דקות למשך 2-3 שעות. שחרור ההורמון הסומטוטרופי לאחר גירוי נחשב נורמלי לפחות עד 7-10 ננוגרם/מ"ל, לפעמים הוא מגיע ל-20-40 ננוגרם/מ"ל. אם אין תגובה באחת הדגימות, מתבצעות בדיקות חוזרות עם ממריצים אחרים. חוסר בהורמון הסומטוטרופי נחשב מוכח בהיעדר שחרור הורמון סומטוטרופי ב-2-3 דגימות שונות.
בדיקות הגירוי הנפוצות ביותר הן: עם מתן תוך ורידי של 0.1 יחידות (0.75-1.5 יחידות) אינסולין לכל 1 ק"ג ממשקל הגוף של המטופל והשגת היפוגליקמיה (ירידה ברמת הגלוקוז בדם ב-50% בהשוואה לרמה ההתחלתית), נקבע רמת ההורמון הסומטוטרופי בסרום לפי התוכנית הנ"ל. אם מתפתחת היפוגליקמיה חמורה, הבדיקה מופסקת, והמטופל מקבל גלוקוז תוך ורידי. זוהי שיטת האבחון הקלאסית הנפוצה ביותר.
TRH במינון של 200-500 מק"ג דרך הווריד. מזהה ביעילות עתודות הורמונים, אינו גורם לסיבוכים. בשילוב עם בדיקת אינסולין, הוא מאפשר לשפוט את רמת הנזק למערכת ההיפותלמוס-יותרת המוח. תגובה חיובית ל-TRH בהיעדר היפוגליקמיה על ידי אינסולין מעידה על שלמות בלוטת יותרת המוח ונזק ברמה ההיפותלמוס, תגובות שליליות ל-TRH והיפוגליקמיה מעידות על נזק לבלוטת יותרת המוח עצמה.
TRH, LH-RH במינון של 300 מק"ג תוך ורידי דומה לקודם.
הורמון גדילה אנושי (SGH) הוא אנלוג סינתטי של תרכובת פעילה ביולוגית שבודדת מגידול בלבלב. נכון לעכשיו, קיימים 3 סוגים של SGH סינתטי: עם 29, 40 ו-44 שאריות חומצות אמינו. הוא משמש דרך הווריד במינונים של 1 עד 3 מיקרוגרם / ק"ג ממשקל גוף המטופל. שחרור STH נצפה 15-20 דקות לאחר מתן הבדיקה, הבדיקה יעילה יותר מאחרות בגילוי עתודות של הורמון גדילה אנדוגני. תגובת SGH חיובית מצביעה על רמת נזק היפותלמוס לתפקוד הסומטוטרופי ובלוטת יותרת המוח שלמה; עם חומצות אמינו (L-ארגינין מונוכלוריד, אורניטין, טריפטופן, גליצין, לאוצין) דרך הווריד במינון של 0.25-0.5 גרם לכל 1 ק"ג ממשקל גוף המטופל. יעיל לחקר עתודות SGH. עלול לגרום לתגובות אלרגיות.
L-dopa דרך הפה במינון של 250-500 מק"ג. יעיל, נסבל היטב על ידי מטופלים.
נעשה שימוש גם בבדיקות עם גלוקגון, ברום ארגוקריפטין (פרלודל), ליזין וזופרסין, קלונידין ועומס ארגומטרי במינון על אופניים.
מחקר מצב התפקוד הסומטוטרופי נחוץ לא רק לאבחון גמדות, אלא גם לבחירה מוצדקת של שיטת טיפול, שכן טיפול בסומטוטרופין הוא רציונלי רק במקרה של חוסר בהורמון גדילה אנדוגני.
לצורך אבחון צורת הגמדות, חשוב מאוד לחקור את תכולת גורמי הגדילה דמויי האינסולין, או סומטומדינים (במיוחד IGF-1, או סומטומדין C) - מתווכים של פעולת הורמון סומטוטרופי ברמת הרקמה. ידוע שתכולת סומטומדין C בגמדות מופחתת, ובאקרומגליה - גבוהה יותר בהשוואה לנורמה. צורת הגמדות המתוארת על ידי לרון היא סוג של מחלה עם ייצור תקין של הורמון גדילה מסוג STH, אך עם הפרעה ביצירת IGF-1 ו-IGF-II. טיפול בחולים כאלה עם סומטוטרופין הוא חסר תועלת.
אינדיקטורים עקיפים לתפקוד הסומטוטרופי של בלוטת יותרת המוח הם פעילות הפוספטאז הבסיסי ותכולת הזרחן האנאורגני בסרום. בתנאים היפוסומטוטרופיים, אינדיקטורים אלה מופחתים. בצורה הפאן-היפופיטוטרית של גמדות, הפרשת הגונדוטרופינים, לרוב TSH, מופחתת, המלווה בירידה מקבילה בתפקודי בלוטות המין (מחסור באנדרוגנים או אסטרוגנים), בלוטת התריס (ירידה ברמות T3 , T4 , יוד הקשור לחלבון - PBI, הצטברות של 131I על ידי בלוטת התריס), ובלוטות יותרת הכליה (ירידה בכמות הקורטיזול ו-17-OCS בפלזמה, הפרשת 17-KC ו-17-OCS בשתן, לימפוציטוזיס).
כל סוגי הגמדות הגנטית של בלוטת יותרת המוח (היפותלמוס-יותרת המוח) מאופיינים במחלות חוזרות ונשנות של ילדים במשפחה עם תורשה אוטוזומלית רצסיבית (לרוב) או אוטוזומלית דומיננטית, פיגור בגדילה והתפתחות גופנית מגיל 2-4 שנים עם פיגור של לפחות 2-3 מעלות מנורמות הגדילה הממוצעות עבור מין, גיל ואוכלוסייה נתונים, עם דינמיקת גדילה שנתית ספונטנית נמוכה, התאבנות מאוחרת. עם רמה נמוכה של הורמון סומטוטרופי (ב-2-3 בדיקות גירוי מתחת ל-7 ננוגרם/מ"ל), טיפול בהורמון סומטוטרופי יעיל ביותר (נותן עלייה בגובה של לפחות 7 ס"מ בשנה). עם רמה תקינה או גבוהה של הורמון סומטוטרופי (עם חוסר הפעילות הביולוגית שלו), ניתן לשמור על רגישות להורמון. לא נצפים שינויים באינטליגנציה.
בגמדות גנטית עם חוסר רגישות רקמות להורמון סומטוטרופי, התמונה הקלינית דומה לחסר בודד בהורמון גדילה, אך טיפול בסומטוטרופינים אינו יעיל. בקבוצה זו ניתן להבחין בין הצורות העיקריות הבאות לפי רמת ה-IRF: עם תכולה תקינה (פגם בקולטן IRF) וגמדות מופחתת - מסוג Laron (חסר IRF-1 ו-IRF-II) והסוג המצוי בפיגמים אפריקאים (חסר IRF-1).
גמד מוחי מאופיין במחלות מבודדות במשפחה הקשורות לנזק תוך רחמי או לאחר לידה למערכת העצבים המרכזית, עם נוכחות של שינויים אורגניים ברורים במערכת העצבים המרכזית, לעתים קרובות בשילוב עם פתולוגיה של איבר הראייה, נוכחות של סוכרת תפלה, שימור תפקודים גונדוטרופיים ושינויים באינטליגנציה.
סוגים מסוימים של דיסגנזה ואיגנזה של הגונדות מלווים בקומה נמוכה בולטת, בפרט תסמונת שרשבסקי-טרנר ותסמונת דיסגנזה אשכית בצורת "טרנרואיד" (מוזאית). מחקרים ציטוגנטיים (כרומטין מיני, קריוטיפ) מסייעים באבחנה מבדלת, וחושפים פגמים כרומוזומליים, כמו גם פגמים אופייניים של התפתחות סומטית ומינית, רמות תקינות או גבוהות של הורמון סומטוטרופי אנדוגני, וחוסר רגישות לטיפול בסומטוטרופין.
מבין הפרעות אנדוקריניות המופיעות עם קומה נמוכה, יש להבחין בהיפותירואידיזם ראשוני, הנגרמת על ידי היפופלזיה מולדת או אפלזיה של בלוטת התריס, דיסטופיה שלה, פגמים אנזימטיים בביוסינתזה של הורמוני בלוטת התריס, ונזק אוטואימוני מוקדם לבלוטת התריס. בכל המצבים הללו, סימנים של תת פעילות של בלוטת התריס עם רמה גבוהה של TSH, ירידה ב-T4 ו-T3 בסרום הדם שולטים . במיקסדמה שמקורה במחלה אוטואימונית, מתגלים בדם נוגדנים לתירוגלובולין, שברים מיקרוזומליים וגרעיניים של רקמת בלוטת התריס, ורמת ההורמון הסומטוטרופי תקינה או מופחתת. ניתן להשיג את ההשפעה הקלינית על ידי פיצוי על תת פעילות של בלוטת התריס בלבד.
קומה נמוכה מלווה בהתפתחות מינית מוקדמת ותסמונת אדרנוגניטלית עקב סגירה מוקדמת של אזורי גדילה; מחלת איטסנקו-קושינג, המופיעה בילדות עקב ההשפעה המעכבת של גלוקוקורטיקואידים על הפרשת הורמון סומטוטרופי והשפעתם הקטבולית; תסמונת מאוריאק - קומה נמוכה ואינפנטיליזם של חולים עם סוכרת תלוית אינסולין קשה.
יש להבדיל בין גמדיות בלוטת יותרת המוח לבין עיכוב סומטוגני בהתפתחות הפיזית הנגרם על ידי הפרעות מטבוליות כרוניות (במחלות כבד, כליות, מערכת העיכול), היפוקסיה כרונית (במחלות של מערכות הלב וכלי הדם והנשימה, באנמיה); עם מחלות מערכתיות של מערכת השרירים והשלד (כונדרודיסטרופיה, אוסטאוגנזה לא מושלמת, מחלת אקסוסטוזיס) וכו'.
פיגור בגדילה תפקודי (קונסטיטוציונלי) נצפה לעיתים עם תחילת גיל ההתבגרות המאוחר אצל מתבגרים בריאים לכאורה; מצאנו שהוא קשור בעיקר לחוסר זמני של פעילות גונדוטרופית. הפרשת הורמון סומטוטרופי בדרך כלל אינה נפגעת או מופחתת מעט. גירוי של גונדוטרופינים יכול להאיץ הן את ההתפתחות המינית והן את הגדילה.
יש להתייחס לקומה נמוכה בעלת אופי משפחתי כאל גרסה של התפתחות פיזיולוגית.
מה צריך לבדוק?
כיצד לבחון?
אילו בדיקות נדרשות?
למי לפנות?
יַחַס גמדות
טיפול בגמדים הוא תהליך ארוך. זה מאלץ את הרופא לפזר את אמצעי ההשפעה על הגדילה לאורך זמן על מנת להשיג את האפקט הקליני הגדול ביותר תוך שמירה על 2 עקרונות בסיסיים:
- קירוב מקסימלי של התפתחות הנגרמת על ידי טיפול לתנאים פיזיולוגיים;
- תוך חסות על אזורי הצמיחה האפיפיזה.
ניסיון רב שנים בטיפול בגמדים מאפשר לנו לשקול את סכמת הטיפול המדורגת הבאה כמתאימה. אבחון גמדים אצל חולים בוגרים בדרך כלל אינו מעורר ספקות. אצל ילדים קטנים, אם התמונה הקלינית אינה ברורה, יש צורך בתקופת אבחון: 6-12 חודשים תחת השגחה ללא טיפול הורמונלי. במהלך תקופה זו נקבע טיפול כללי מורכב לחיזוק הגוף; תזונה נאותה עם עלייה בתכולת החלבון מן החי, ירקות ופירות בתזונה, ויטמינים A ו-D, תכשירים של סידן וזרחן. היעדר שינויים מספיקים בגדילה ובהתפתחות הפיזית על רקע זה וגילוי הפרעות אנדוקריניות במהלך הבדיקה הם הבסיס להתחלת טיפול הורמונלי.
הסוג העיקרי של טיפול פתוגנטי לגמדות בלוטת יותרת המוח הוא השימוש בהורמון גדילה אנושי, מכיוון שהופעתם של רוב מקרי הגמדות תלויה ללא ספק בצורה כזו או אחרת של מחסור בו. בשל הספציפיות למין של הורמון זה, רק סומטוטרופין אנושי ופרימטים פעיל עבור בני אדם. תרופה המבודדת מבלוטת יותרת המוח של אנשים שמתו ממחלות לא זיהומיות ולא סרטניות נמצאת בשימוש נרחב במרפאה. סומטוטרופין אנושי מתקבל על ידי סינתזה חיידקית באמצעות אשריכיה קולי באמצעות הנדסה גנטית. סומטוטרופין אנושי מסונתז גם הוא כימי, אך הוא יקר ביותר וכמעט ולא נמצא בשימוש במרפאה. חולים עם מחסור מוכח בהורמון גדילה אנדוגני, עם התמיינות שלדית שאינה עולה על הרמה האופיינית לגילאי 13-14, נבחרים לטיפול בסומטוטרופין. אין הגבלות גיל לטיפול.
המינונים המינימליים האפקטיביים שניתן להשתמש בהם בתקופה הראשונה של הטיפול הם 0.03-0.06 מ"ג/ק"ג משקל גוף. המינונים היעילים ביותר הם 2-4 מ"ג 3 פעמים בשבוע. העלאת המינון הבודד ל-10 מ"ג לא לוותה בעלייה מספקת בהשפעת הגדילה, אך גרמה להיווצרות מהירה של נוגדנים לסומטוטרופין.
בארצנו, נערכת עבודה על חקר הורמון גדילה אנושי מאז 1960. נבדקו שני משטרי טיפול: רציף ורציף עם טיפולים בני 2-3 חודשים ובמרווחים זהים ביניהם. העלייה הממוצעת בגובה של המטופלים במהלך שנת הטיפול הראשונה הייתה 9.52±0.39 ס"מ, העלייה במשקל הגוף הייתה 4.4±0.14 ק"ג. עם טיפול רציף ארוך טווח, העלייה הממוצעת בגובה הייתה 0.82 ס"מ/חודש, משקל גוף - 0.38 ק"ג/חודש; עם טיפול לסירוגין - 0.75 ס"מ/חודש ו-0.4 ק"ג/חודש, בהתאמה. טיפול רציף סיפק עלייה מהירה יותר בגובה עם ירידה חדה בהשפעה לאחר 1-1.5 שנים, עם טיפול לסירוגין, היעילות נשמרה במשך 3-4 שנים, מה שמאפשר לנו לשקול את משטר הטיפול כמתאים יותר. קביעת רמת IGF-I (סומטומדין C) יכולה לשמש כאינדיקטור אמין לרגישות המטופל לטיפול בתרופות סומטוטרופין. עלייה בתכולת IGF-I לאחר מתן הורמון סומטוטרופי מאפשרת לחזות השפעה חיובית של הטיפול. יתרון חשוב של טיפול בסומטוטרופין הוא היעדר האצה של התאבנות השלד על רקע זה.
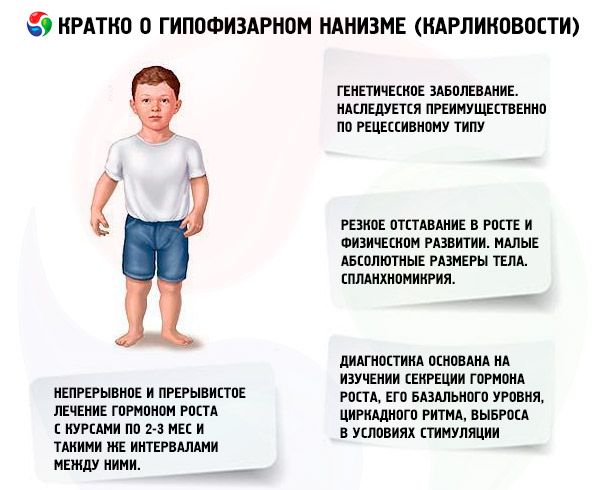
האמצעי החשוב ביותר לטיפול בגמדים הוא שימוש בסטרואידים אנבוליים, המגרים גדילה על ידי הגברת סינתזת החלבון והעלאת רמת ההורמון הסומטופרופי האנדוגני. הטיפול מתבצע במשך מספר שנים, עם החלפה הדרגתית של תרופות מסוימות באחרות, מתרכובות פחות פעילות לתרכובות פעילות יותר. שינוי בתרופות אנבוליות מסומן כאשר אפקט הגדילה פוחת לאחר 2-3 שנים, מה שמוביל לעלייה נוספת בגדילה. הטיפול מתבצע בקורסים (תקופת המנוחה צריכה להיות מחצית מתקופת הטיפול). במקרה של התמכרות, מסומנים גם הפסקות ארוכות יותר (עד 4-6 חודשים). רק אחד מהסטרואידים האנבוליים נקבע בכל פעם. שילוב של 2 תרופות או יותר אינו מתאים, מכיוון שהדבר אינו משפר את השפעתן המטבולית והגדילתית. האחרון תלוי בעיקר בגיל המטופלים ובמידת ההתמיינות של עצמות השלד בתחילת הטיפול. ההשפעה הטובה ביותר נצפית במטופלים מתחת לגיל 16-18 עם אוסיפיקציה שלדית שאינה עולה על הרמה האופיינית לילד בן 14. מומלץ להתחיל טיפול מיד לאחר האבחון, בדרך כלל מגיל 5-7 שנים. לפני הטיפול, יש להימנע ממתן גונדוטרופינים והורמוני מין, אשר, תוך כדי גירוי גדילה, מאיצים בו זמנית את התמיינות השלד. עיקרון מינון הסטרואידים האנבוליים הוא מהמינונים היעילים המינימליים ועד להגדלה הדרגתית. המינונים המומלצים של התרופות הנפוצות ביותר: נרובול (מתנדרוסטנול, דיאנבול) - 0.1-0.15 מ"ג לכל 1 ק"ג משקל גוף ליום דרך הפה; נרובוליל (דורבולין) - 1 מ"ג לכל 1 ק"ג משקל גוף לחודש באופן שרירי, המינון החודשי ניתן ב-2-3 מנות, בהתאמה, לאחר 15 או 10 ימים; רטבוליל (דקה-דורבולין) - 1 מ"ג לכל 1 ק"ג משקל גוף פעם בחודש באופן שרירי. חריגה מהמינונים שצוינו עלולה להוביל לאנדרוגניזציה. במינונים פיזיולוגיים, תרכובות אלו אינן משפיעות באופן משמעותי על מצב איברי המין ועל התמיינות עצמות השלד, מה שמאפשר שימוש ממושך בחולים משני המינים. בנות צריכות להיות תחת פיקוחו של גינקולוג, שכן במקרה של מנת יתר או רגישות אישית מוגברת, חלק מהמטופלות עלולות לפתח סימני ויריליזציה, אשר חולפים במהירות עם הפסקת הטיפול. תרופות דרך הפה שעברו מתילציה לאתילציה בעמדה ה-17 עלולות לעיתים לגרום להשפעה כולסטטית, לכן, במחלות כבד, יש לתת עדיפות לתרכובות אנבוליות פרנטרליות, או לשלב תרופות דרך הפה עם חומרים כולרטיים. לעיתים רחוקות מאוד, טיפול בסטרואידים אנבוליים עלול לגרום לתגובות אלרגיות (גירוד, פריחות). בהיעדר סיבוכים, משתמשים בסטרואידים אנבוליים כל עוד נצפית אפקט גדילה (עד 16-18 שנים, ולפעמים יותר). הטיפול מתבצע על רקע טיפול מחזק כללי.
אם לחולים יש סימנים של תת פעילות של בלוטת התריס, תרופות לבלוטת התריס (תירוקסין, תירואידין, תירומטום) נקבעות בו זמנית במינונים שנבחרו באופן אישי.
בטיפול בבנים, השלב הבא הוא מתן גונדוטרופין כוריוני אנושי (HCC). תרופה זו משמשת לא לפני גיל 15-16, ולעתים קרובות אף בגיל מאוחר יותר כדי לעורר תאי ליידיג, מה שמאיץ הן את ההתפתחות המינית והן את הגדילה (בשל הפעילות האנבולית של האנדרוגנים שלהם). מינונים של 1000 עד 1500 יחידות בינלאומיות (IU) משמשים 1-2 פעמים בשבוע תוך שרירית בקורסים בני חודשיים, לא יותר מ-2-3 פעמים בשנה. אם ההשפעה אינה שלמה, הטיפול בגונדוטרופין כוריוני אנושי בבנים מגיל 16 ומעלה מתחלף עם מתן מינונים קטנים של אנדרוגנים (מתיל-טסטוסטרון במינון של 5-10 מ"ג/יום תת-לשוני).
בנות מעל גיל 16 יכולות להתחיל טיפול במינונים קטנים של אסטרוגנים, המדמים מחזור מיני תקין. הטיפול מתבצע במשך 3 שבועות בכל חודש, ולאחר מכן יש הפסקה. בשלב השני של המחזור, החל מהשבוע השלישי, ניתן לרשום גונדוטרופין כוריוני במינון של 1000-1500 יחב"ל 3-5 פעמים בשבוע או תרופות בעלות השפעה גסטגנית (פרגנין, פרוגסטרון).
השלב הסופי של הטיפול (לאחר סגירת אזורי הגדילה) הוא מתן קבוע של מינונים טיפוליים של הורמוני מין התואמים למין המטופל, על מנת לפתח באופן מלא את איברי המין, מאפיינים מיניים משניים, להבטיח ליבידו ועוצמה מינית. תכשירים משולבים של אסטרוגן-פרוגסטרון (נון-אובלון, ביסקורין, אינפקונדין, ריגווידון) נוחים לטיפול בחולות, ותכשירים של אנדרוגן בשחרור ממושך (טסטנט, סוסטנון-250, אומנדרן-250) נוחים לטיפול בחולים גברים.
מתבצע טיפול כללי לחיזוק הגוף (משטר, תזונה מבוססת חלבונים וירקות, טיפול בוויטמינים, ביו-סטימולנטים). מומלץ להשתמש בתכשירי אבץ, שתפקידם העיקרי הוא הגברת הפעילות של IGF-1 (גורם גדילה דמוי אינסולין I).
בנוכחות פתולוגיה אורגנית ממערכת העצבים המרכזית, מנוהל טיפול אנטי דלקתי, ספיגה והתייבשות. טיפול שיטתי ממוקד נותן אפקט מעודד. כתוצאה מטיפול מדורג וארוך טווח, 148 (80.4%) מתוך 175 חולים עם גמדות משני המינים הצליחו להגיע לגובה של מעל 130 ס"מ, 92 (52.5%) - מעל 140 ס"מ, ו-32 (18.3%) - 150-160 ס"מ ומעלה. במקביל, 37 חולים (21.2%) הגדילו את גובהם ב-30 ס"מ, 107 (61.1%) ב-31-50 ס"מ, ו-31 (17.7%) ב-51-60 ס"מ ומעלה.
תַחֲזִית
הפרוגנוזה תלויה בצורת הגמדות. בסוגים גנטיים של גמדות, הפרוגנוזה לכל החיים חיובית. בנוכחות גידול בבלוטת יותרת המוח ונזק אורגני למערכת העצבים המרכזית, היא נקבעת על ידי הדינמיקה של התפתחות התהליך הפתולוגי העיקרי. שיטות טיפול מודרניות הגדילו משמעותית את היכולות הפיזיות ואת כושר העבודה של החולים, והאריכו את תוחלת חייהם. במהלך תקופת הטיפול הפעיל, יש צורך בבדיקת רופא כל 2-3 חודשים, עם טיפול תחזוקתי - כל 6-12 חודשים.
העסקת מטופלים התואמת את יכולותיהם האינטלקטואליות והפיזיות היא בעלת חשיבות עליונה להסתגלותם החברתית.
מומלץ לבחור במקצועות שאינם קשורים למאמץ פיזי כבד, אך מאפשרים להפגין יכולות אינטלקטואליות, יכולת לבצע עבודה מדויקת ושפות.


 [
[