
כל תוכן iLive נבדק מבחינה רפואית או נבדק למעשה כדי להבטיח דיוק עובדתי רב ככל האפשר.
יש לנו קווים מנחים קפדניים המקור רק קישור לאתרים מדיה מכובד, מוסדות מחקר אקדמי, בכל עת אפשרי, עמיתים מבחינה רפואית מחקרים. שים לב שהמספרים בסוגריים ([1], [2] וכו ') הם קישורים הניתנים ללחיצה למחקרים אלה.
אם אתה סבור שתוכן כלשהו שלנו אינו מדויק, לא עדכני או מפוקפק אחרת, בחר אותו ולחץ על Ctrl + Enter.
ה-FDA אישר את Bimzelx לטיפול בהידרדניטיס
סקירה אחרונה: 02.07.2025
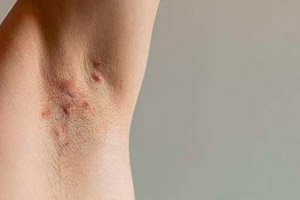
מנהל המזון והתרופות האמריקאי (FDA) אישר את התרופה Bimzelx (bimekizumab-bkzx) של UCB לטיפול במבוגרים הסובלים מהידרדניטיס סופורטיבה בדרגה בינונית עד חמורה.
בימזלקס היא התרופה הראשונה והיחידה שאושרה אשר מעכבת באופן סלקטיבי את אינטרלוקין 17F (IL-17F) בנוסף לאינטרלוקין 17A (IL-17A). זוהי האינדיקציה החמישית לבימזלקס בארצות הברית.
בסיס לאישור:
האישור מבוסס על נתונים משני ניסויים קליניים שלב III (BE HEARD I ו-BE HEARD II) שבוצעו בחולים בוגרים עם הידראדניטיס סופורטיבה בינונית עד חמורה.
מדד ביצועים מרכזי:
- HiSCR50: בשבוע 16, שיעור גבוה משמעותית של חולים שטופלו בבימזלקס השיגו שיפור של ≥50% בסימנים ובתסמינים של הידרדניטיס סופורטיבה (כפי שנמדד על ידי ציון התגובה הקלינית של הידרדניטיס סופורטיבה (HiSCR50)) בהשוואה לפלצבו.
אינדיקטור משני:
- HiSCR75: התרופה סיפקה גם שיפורים משמעותיים קלינית בחולים שהשיגו שיפור של ≥75% (HiSCR75) בשבוע 16, בהשוואה לפלצבו.
קיימות התוצאות:
- התגובות הקליניות נשמרו עד שבוע 48, ללא זיהוי אותות בטיחות חדשים.
חוות דעת מומחה:
ד"ר אלכסה ב. קימבל, חוקרת תוכנית BE HEARD ורופאת עור במרכז הרפואי בית ישראל דיקונס בבוסטון, אמרה:
"אישור Bimzelx לטיפול בהידרדניטיס סופורטיבה בדרגה בינונית עד חמורה הוא התפתחות חשובה בהתחשב בצורך הקליני המשמעותי שלא נענה ובמספר המוגבל של אפשרויות טיפול הזמינות כיום."
