
כל תוכן iLive נבדק מבחינה רפואית או נבדק למעשה כדי להבטיח דיוק עובדתי רב ככל האפשר.
יש לנו קווים מנחים קפדניים המקור רק קישור לאתרים מדיה מכובד, מוסדות מחקר אקדמי, בכל עת אפשרי, עמיתים מבחינה רפואית מחקרים. שים לב שהמספרים בסוגריים ([1], [2] וכו ') הם קישורים הניתנים ללחיצה למחקרים אלה.
אם אתה סבור שתוכן כלשהו שלנו אינו מדויק, לא עדכני או מפוקפק אחרת, בחר אותו ולחץ על Ctrl + Enter.
בלוטות יותרת התריס
המומחה הרפואי של המאמר
סקירה אחרונה: 04.07.2025

בשנת 1879, תיאר המדען השוודי ס. סנדסטרום את בלוטות יותרת התריס בבני אדם ונתן להן שם. בלוטות יותרת התריס הן איברים חיוניים. תפקידן הוא לייצר ולהפריש הורמון יותרת תריס (PTH), אחד המווסתים העיקריים של חילוף החומרים של סידן וזרחן.
בלוטת יותרת התריס העליונה (glandula parathyroidea superior) ובלוטת יותרת התריס התחתונה (glandula parathyroidea inferior) הן גופים עגולים או סגלגלים הממוקמים על המשטח האחורי של כל אחת מאונות בלוטת התריס: בלוטה אחת בחלק העליון, השנייה בחלק התחתון. אורך כל בלוטה הוא 4-8 מ"מ, הרוחב הוא 3-4 מ"מ, העובי הוא 2-3 מ"מ. מספר הבלוטות הללו אינו קבוע ויכול לנוע בין 2 ל-7-8, בממוצע יש ארבע. המסה הכוללת של הבלוטות היא בממוצע 1.18 גרם.
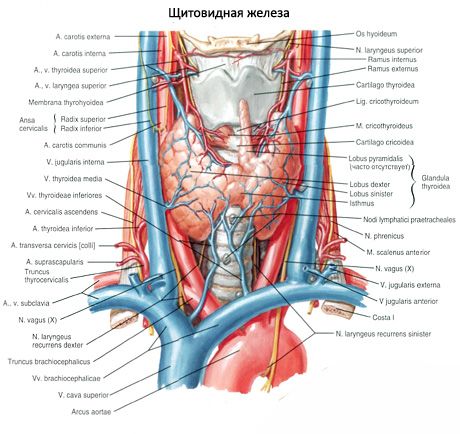
בלוטות הפרתירואיד נבדלות מבלוטת התריס בצבען הבהיר יותר (אצל ילדים הן ורודות חיוורות, אצל מבוגרים - חום-צהבהב). לעיתים קרובות בלוטות הפרתירואיד ממוקמות במקום החדירה של רקמת התריס על ידי עורקי התריס התחתונים או ענפיהן. בלוטות הפרתירואיד מופרדות מהרקמות הסובבות אותן על ידי קפסולה סיבית משלהן, שממנה משתרעות שכבות רקמת חיבור אל תוך הבלוטות. האחרונות מכילות מספר רב של כלי דם ומחלקות את בלוטות הפרתירואיד לקבוצות של תאי אפיתל.
הפרנכימה של הבלוטות נוצרת על ידי פאראתירוציטים ראשיים ואצידופיליים, היוצרים מיתרים ואשכולות המוקפים בצרורות דקים של סיבי רקמת חיבור. שני סוגי התאים נחשבים לשלבים שונים של התפתחות פאראתירוציטים. לפאראתירוציטים הראשיים יש צורה רב-אדרית, ציטופלזמה בזופילית עם מספר רב של ריבוזומים. בין תאים אלה נבדלים תאים כהים (המפרישים באופן פעיל) ותאים בהירים (פחות פעילים). פאראתירוציטים אצידופיליים הם גדולים, בעלי קווי מתאר ברורים, מכילים מיטוכונדריה קטנה רבה עם חלקיקי גליקוגן.
הורמון הפרתירואיד, פאראתירוקסין (הורמון פרתירואיד), הוא חלבון בהרכבו והוא מעורב בוויסות חילוף החומרים של זרחן וסידן. הורמון פרתירואיד מפחית את הפרשת הסידן בשתן ומגביר את ספיגתו במעי בנוכחות ויטמין D. תירוקלציטונין הוא אנטגוניסט של הורמון פרתירואיד.
אמבריוגנזה של בלוטות יותרת התריס
בלוטות הפרתירואיד מתפתחות מהאפיתל של כיסי הזימים השלישי והרביעי המזווגים. בשבוע השביעי להתפתחות, יסודות האפיתל של הגופים נפרדים מדפנות כיסי הזימים, ובתהליך הגדילה נעים בכיוון הזנב. לאחר מכן, בלוטות הפרתירואיד הנוצרות תופסות עבורן מקום קבוע על המשטחים האחוריים של האונות הימנית והשמאלית של בלוטת התריס.
 [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
[ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
כלי דם ועצבים של בלוטות יותרת התריס
אספקת הדם לבלוטות יותרת התריס מסופקת על ידי ענפים של עורקי בלוטת התריס העליונים והתחתונים, כמו גם ענפי הוושט והקנה. דם ורידי זורם החוצה דרך הוורידים בעלי אותו שם. העצבוב של בלוטות יותרת התריס דומה לעצבוב של בלוטת התריס.
מאפיינים הקשורים לגיל של בלוטות יותרת התריס
המסה הכוללת של בלוטות יותרת התריס אצל יילוד נעה בין 6 ל-9 מ"ג. במהלך שנת החיים הראשונה, המסה הכוללת שלהן עולה פי 3-4, עד גיל 5 היא מכפילה את עצמה שוב, ובגיל 10 היא משולשת. לאחר 20 שנה, המסה הכוללת של ארבע בלוטות יותרת התריס מגיעה ל-120-140 מ"ג ונשארת קבועה עד גיל מבוגר. בכל הגילאים, המסה של בלוטות יותרת התריס אצל נשים גדולה מעט מאשר אצל גברים.
בדרך כלל לאדם יש שני זוגות של בלוטות יותרת התריס (עליונות ותחתונות), הממוקמות על המשטח האחורי של בלוטת התריס, מחוץ לקפסולה שלה, ליד הקטבים העליונים והתחתונים. עם זאת, מספרן ומיקומן של בלוטות יותרת התריס יכול להשתנות; לפעמים ניתן למצוא עד 12 בלוטות יותרת התריס. הן יכולות להיות ממוקמות ברקמת בלוטת התריס ובלוטות התימוס, במדיאסטינום הקדמי והאחורי, בקרום הלב, מאחורי הוושט, באזור הסתעפות עורק התרדמה. לבלוטות יותרת התריס העליונות יש צורה של ביצית שטוחה, התחתונות כדוריות. מידותיהן הן בערך בין 6x3 ל-4x1.5 - 3 מ"מ, המשקל הכולל הוא בין 0.05 ל-0.5 גרם, הצבע אדמדם או חום-צהבהב. אספקת הדם לבלוטות יותרת התריס מתבצעת בעיקר על ידי ענפי עורק התריס התחתון, זרימה ורידית מתרחשת דרך הוורידים של בלוטת התריס, הוושט וקנה הנשימה. בלוטות הפרתירואיד עוברות עצבוב על ידי סיבים סימפתטיים של עצבי הגרון החוזרים והעליונות, העצבוב הפרה-סימפתטי מתבצע על ידי עצבי הואגוס. בלוטות הפרתירואיד מכוסות בקפסולה דקה של רקמת חיבור; מחיצות היוצאות ממנה חודרות לתוך הבלוטות. הן מכילות כלי דם וסיבי עצב. הפרנכימה של בלוטות הפרתירואיד מורכבת מפרתירוציטים, או תאים ראשיים, שביניהם, בהתאם למידת הצביעה, נבדלים תאים בהירים או מבריקים פעילים הורמונלית, כמו גם תאים כהים במנוחה. התאים הראשיים יוצרים אשכולות, חוטים ואשכולות, ובקשישים - זקיקים עם קולואיד בחלל. אצל מבוגרים מופיעים תאים, הממוקמים בעיקר לאורך פריפריה של בלוטות הפרתירואיד, צבועים באאוזין - תאים אאוזינופיליים או אוקסיפיליים, שהם תאים ראשיים מנוונים. בבלוטות הפרתירואיד ניתן למצוא גם צורות מעבר בין התאים הראשיים לתאים האוקסיפיליים.
ההצלחות הראשונות בהבהרת סוגיות הסינתזה, פענוח המבנה וחקר חילוף החומרים של הורמון הפרהתירואיד הושגו לאחר 1972. הורמון הפרהתירואיד הוא פוליפפטיד חד-שרשרתי המורכב מ-84 שאריות חומצות אמינו, ללא ציסטאין, בעל משקל מולקולרי של כ-9500 דלטון, הנוצר בבלוטות הפרהתירואיד מביו-קודמן - הורמון פרהתירואיד (proPTH), בעל 6 חומצות אמינו נוספות בקצה NH2 . ProPTH מסונתז בתאים העיקריים של בלוטות הפרהתירואיד (ברטיקולום האנדופלסמי הגרגירי שלהן) ובתהליך הביקוע הפרוטאוליטי במנגנון גולג'י מומר להורמון פרהתירואיד. הפעילות הביולוגית שלו נמוכה משמעותית מפעילות ה-PTH. ככל הנראה, proPTH נעדר בדם של אנשים בריאים, אך במצבים פתולוגיים (עם אדנומה של בלוטות הפרהתירואיד) הוא יכול להפריש לדם יחד עם PTH. לאחרונה התגלה קודמן של proPTH, preproPTH, המכיל 25 שאריות חומצות אמינו נוספות בקצה NH2. לכן, preproPTH מכיל 115 שיירי חומצות אמינו, proPTH - 90, ו-PTH - 84.
המבנה של הורמון פרתירואיד בבקר ובחזיר נקבע במלואו. הורמון פרתירואיד אנושי בודד מאדנומות של בלוטת פרתירואיד, אך מבנהו פוענח רק באופן חלקי. ישנם הבדלים במבנה של הורמון פרתירואיד, אך הורמוני פרתירואיד של בעלי חיים ואנושיים מפגינים ריאקטיביות צולבת. הפוליפפטיד המורכב מ-34 שיירי חומצות האמינו הראשונים שומר למעשה על הפעילות הביולוגית של ההורמון הטבעי. זה מאפשר לנו להניח שכמעט האחוזים הנותרים של המולקולה בקצה הקרבוקסיל אינם קשורים ישירות להשפעות העיקריות של הורמון פרתירואיד. פרגמנט 1-29 של הורמון פרתירואיד מפגין גם פעילות ביולוגית ואימונולוגית מסוימת. פרגמנט 53-84, שאינו פעיל ביולוגית, מפגין גם השפעה אימונולוגית, כלומר תכונות אלו של הורמון פרתירואיד מוצגות על ידי לפחות 2 מקטעים של המולקולה שלו.
הורמון הפרהתירואיד המסתובב בדם הוא הטרוגני ושונה מההורמון הטבעי המופרש על ידי בלוטות הפרהתירואיד. לפחות שלושה סוגים שונים של הורמון פרהתירואיד נבדלים בדם: הורמון פרהתירואיד שלם בעל משקל מולקולרי של 9,500 דלטון; חומרים לא פעילים ביולוגית מהחלק הקרבוקסילי של מולקולת הורמון הפרהתירואיד בעל משקל מולקולרי של 7,000-7,500 דלטון; חומרים פעילים ביולוגית בעלי משקל מולקולרי של כ-4,000 דלטון.
שברים קטנים אף יותר נמצאו בדם ורידי, דבר המצביע על כך שהם נוצרו בפריפריה. האיברים העיקריים שבהם נוצרו שברי הורמון פרתירואיד היו הכבד והכליות. פרגמנטציה של הורמון פרתירואיד באיברים אלה הייתה מוגברת בפתולוגיות כבד ובאי ספיקת כליות כרונית (CRF). בתנאים אלה, שברי הורמון פרתירואיד נשארו בזרם הדם זמן רב יותר באופן משמעותי מאשר אצל אנשים בריאים. הכבד ספג בעיקר הורמון פרתירואיד שלם, אך לא הסיר מהדם שברי הורמון פרתירואיד קרבוקסילי-טרמינלי או אמינו-טרמינלי. הכליות מילאו תפקיד מוביל בחילוף החומרים של הורמון פרתירואיד. הן היוו כמעט 60% מהסילוק המטבולי של הורמון אימונו-ריאקטיבי קרבוקסילי-טרמינלי ו-45% מהשבר האמינו-טרמינלי של הורמון פרתירואיד. האזור העיקרי של חילוף החומרים של השבר האמינו-טרמינלי הפעיל של הורמון פרתירואיד היה עצמות.
זוהתה הפרשה פועמת של הורמון פאראתירואיד, בעוצמה הגבוהה ביותר בלילה. לאחר 3-4 שעות מתחילת שנת הלילה, תכולתו בדם גבוהה פי 2.5-3 מהרמה הממוצעת ביום.
התפקיד העיקרי של הורמון הפרתירואיד הוא לשמור על הומאוסטזיס של סידן. במקביל, סידן בסרום (סך ובמיוחד סידן מיונן) הוא המווסת העיקרי של הפרשת הורמון הפרתירואיד (ירידה ברמות הסידן מגרה הפרשת הורמון הפרתירואיד, בעוד שעלייה מדכאת אותה), כלומר, הוויסות מתבצע על פי עקרון המשוב. בתנאים של היפוקלצמיה, המרת proPTH להורמון פרתירואיד עולה. תכולת המגנזיום בדם ממלאת גם תפקיד חשוב בשחרור הורמון הפרתירואיד (רמתו המוגברת מגרה, בעוד שרמתו המופחתת מדכאת הפרשת הורמון פרתירואיד). המטרות העיקריות של הורמון הפרתירואיד הן הכליות ועצמות השלד, אך ידועה השפעת הורמון הפרתירואיד על ספיגת סידן במעי, סבילות לפחמימות, רמות שומנים בדם, תפקידו בהתפתחות אימפוטנציה, גירוד בעור וכו'.
כדי לאפיין את השפעת הורמון הפרתירואיד על העצמות, יש צורך לספק מידע קצר על מבנה רקמת העצם, המאפיינים של הספיגה הפיזיולוגית והעיצוב מחדש שלה.
ידוע כי עיקר הסידן בגוף (עד 99%) נמצא ברקמת העצם. מכיוון שהוא נמצא בעצם בצורה של תרכובות זרחן-סידן, אחוז מתכולת הזרחן הכוללת נמצא גם בעצמות. הרקמה שלה, למרות אופייה הסטטי לכאורה, עוברת שיפוץ מתמיד, עוברת כלי דם באופן פעיל ובעלת תכונות מכניות גבוהות. העצם היא "מחסן" דינמי של זרחן, מגנזיום ותרכובות אחרות הנחוצות לשמירה על הומאוסטזיס בחילוף החומרים המינרלי. מבנהה כולל רכיבים מינרליים צפופים הקשורים קשר הדוק למטריצה האורגנית, המורכבת מ-90-95% קולגן, כמויות קטנות של מוקופוליסכרידים וחלבונים שאינם קולגן. החלק המינרלי של העצם מורכב מהידרוקסיאפטיט - הנוסחה האמפירית שלו היא Ca10 (PO4) 6 (OH) 2 - וסידן פוספט אמורפי.
עצם נוצרת על ידי אוסטאובלסטים שמקורם בתאי מזנכימה לא מובחנים. אלו הם תאים חד-גרעיניים המעורבים בסינתזה של רכיבים של מטריצת העצם האורגנית. הם ממוקמים בשכבה חד-גרעינית על פני העצם ונמצאים במגע הדוק עם אוסטאואיד. אוסטאובלסטים אחראים על שקיעת האוסטאואיד ועל המינרליזציה שלו לאחר מכן. תוצר פעילותם החיונית הוא פוספטאז אלקליין, שתכולתו בדם היא אינדיקטור עקיף לפעילותם. מוקפים באוסטאואיד שעבר מינרליזציה, חלק מהאוסטאובלסטים הופכים לאוסטאוציטים - תאים חד-גרעיניים, שהציטופלזמה שלהם יוצרת תעלות הקשורות לתעלות של אוסטאוציטים שכנים. הם אינם משתתפים בשיפוץ העצם, אך מעורבים בתהליך ההרס הפרילקונרי, שהוא חשוב לוויסות מהיר של רמות הסידן בסרום הדם. ספיגת העצם מתבצעת על ידי אוסטאוקלסטים - תאים רב-גרעיניים ענקיים, שנוצרים ככל הנראה על ידי איחוי של מקרופאגים חד-גרעיניים. כמו כן, מניחים כי מבשרי האוסטאוקלסטים עשויים להיות תאי גזע המטופויאטיים של מח העצם. הם ניידים, יוצרים שכבה במגע עם העצם, הממוקמת באזורים עם הספיגה הגדולה ביותר שלה. עקב שחרור אנזימים פרוטאוליטיים ופוספטאז חומצי, אוסטאוקלסטים גורמים לפירוק קולגן, הרס הידרוקסיאפטיט והסרת מינרלים מהמטריקס. רקמת עצם חדשה שנוצרה עם מינרליזציה גרועה (אוסטאואידית) עמידה בפני ספיגה אוסטאוקלסטית. תפקודי האוסטאובלסטים והאוסטאוקלסטים הם בלתי תלויים, אך מתואמים זה עם זה, מה שמוביל לעיצוב מחדש תקין של השלד. צמיחת העצם באורך תלויה בהתאבנות האנדוכונדרלית, צמיחה ברוחב ובעובי - בהתאבנות פריאוסטאלית. מחקרים קליניים עם 47 Ca הראו שעד 18% מתכולת הסידן הכוללת בשלד מתחדשת מדי שנה. כאשר עצמות ניזוקות (שברים, תהליכים זיהומיים), העצם שעברה שינוי נספגת ועצם חדשה נוצרת.
קומפלקסים של תאים המעורבים בתהליך המקומי של ספיגת עצם ויצירתה נקראים יחידות שיפוץ רב-תאיות בסיסיות (BMU). הם מווסתים את הריכוז המקומי של סידן, זרחן ויונים אחרים, את הסינתזה של רכיבים אורגניים של העצם, ובפרט קולגן, את ארגונו ואת מינרליזציה שלו.
ההשפעה העיקרית של הורמון הפרתירואיד בעצמות השלד היא הגברת תהליכי הספיגה, המשפיעים הן על רכיבים מינרליים והן על רכיבים אורגניים של מבנה העצם. הורמון הפרתירואיד מקדם את צמיחתם של אוסטאוקלסטים ואת פעילותם, המלווה בהשפעה אוסטאוליטית מוגברת ועלייה בספיגת העצם. במקרה זה, גבישי הידרוקסיאפטיט מתמוססים עם שחרור סידן וזרחן לדם. תהליך זה הוא המנגנון העיקרי להעלאת רמת הסידן בדם. הוא מורכב משלושה מרכיבים: גיוס סידן מהעצם הפרילקונרית (אוסטאוציטים עמוקים); התפשטות תאי אוסטאופרוגנרטור לאוסטאוקלסטים; שמירה על רמה קבועה של סידן בדם על ידי ויסות שחרורו מהעצם (אוסטאוציטים שטחיים).
לפיכך, הורמון פרתירואיד מגביר בתחילה את פעילות האוסטאוציטים והאוסטאוקלסטים, משפר את האוסטאוליזה, וגורם לעלייה ברמת הסידן בדם ולהפרשה מוגברת של סידן ואוקסיפרולין בשתן. זוהי ההשפעה הראשונה, האיכותית והמהירה של הורמון פרתירואיד. ההשפעה השנייה של הורמון פרתירואיד על העצמות היא כמותית. היא קשורה לעלייה במאגר האוסטאוקלסטים. עם אוסטאוליזה פעילה, מתרחש גירוי להגברת התפשטות אוסטאובלסטים, מופעלות גם ספיגה וגם היווצרות עצם עם דומיננטיות של ספיגה. עם עודף של הורמון פרתירואיד, מתרחש מאזן עצם שלילי. זה מלווה בהפרשה מוגזמת של אוקסיפרולין - תוצר של פירוק קולגן וחומצות סיאליות הכלולות במבנה של מוקופוליסכרידים. הורמון פרתירואיד מפעיל אדנוזין מונופוספט מחזורי (cAMP). הפרשה מוגברת של cAMP בשתן לאחר מתן הורמון פרתירואיד יכולה לשמש כאינדיקטור לרגישות הרקמות אליו.
ההשפעה החשובה ביותר של הורמון פרתירואיד על הכליות היא יכולתו להפחית את הספיגה החוזרת של זרחן, ובכך להגביר את הפוספטוריה. מנגנון ההפחתה בחלקים שונים של הנפרון שונה: בחלק הפרוקסימלי, השפעה זו של הורמון פרתירואיד נובעת מחדירות מוגברת ומתרחשת בהשתתפות cAMP, בעוד שבחלק הדיסטלי, היא אינה תלויה ב-cAMP. ההשפעה הפוספטורית של הורמון פרתירואיד משתנה עם מחסור בוויטמין D, חמצת מטבולית וירידה בתכולת הזרחן. הורמוני פרתירואיד מגבירים מעט את הספיגה החוזרת הכוללת של סידן בצינורות. במקביל, הם מפחיתים אותה בחלקים הפרוקסימליים ומגבירים אותה בחלקים הדיסטליים. האחרון הוא בעל חשיבות דומיננטית - הורמון פרתירואיד מפחית את פינוי הסידן. הורמון פרתירואיד מפחית את הספיגה החוזרת של נתרן וביקרבונט שלו בצינורות, מה שעשוי להסביר את התפתחות החמצת בהיפר-פרתירואידיזם. הוא מגביר את היווצרות 1,25-דיאוקסיכולקלציפרול 1,25(OH 2 )D 3 בכליות - הצורה הפעילה של ויטמין D 3. תרכובת זו מגבירה את ספיגת הסידן במעי הדק על ידי גירוי הפעילות של חלבון קושר סידן (CaBP) ספציפי בדופן שלו.
הרמה התקינה של הורמון פרתירואיד היא בממוצע 0.15-0.6 ננוגרם/מ"ל. היא משתנה בהתאם לגיל ולמין. התכולה הממוצעת של הורמון פרתירואיד בדם של אנשים בגילאי 20-29 היא (0.245±0.017) ננוגרם/מ"ל, בגילאי 80-89 - (0.545±0.048) ננוגרם/מ"ל; רמת הורמון פרתירואיד אצל נשים בנות 70 היא (0.728±0.051) ננוגרם/מ"ל, אצל גברים באותו גיל - (0.466±0.40) ננוגרם/מ"ל. לפיכך, תכולת הורמון פרתירואיד עולה עם הגיל, אך במידה רבה יותר אצל נשים.
ככלל, יש להשתמש במספר בדיקות שונות לאבחון המבדל של היפרקלצמיה.
אנו מציגים את הסיווג הקליני והפתוגני שפותח על ידינו, המבוסס על הסיווג של OV Nikolaev ו-VN Tarkaeva (1974).
סיווג קליני ופתוגנטי של מחלות הקשורות להפרשה לקויה של הורמון פאראתירואיד ורגישות אליו
היפרפאראתירואידיזם ראשוני
- לפי פתוגנזה:
- אדנומה(ות) מתפקדות יתר על המידה;
- היפרפלזיה של ה-OGD;
- קרצינומה של בלוטת יותרת התריס בתפקוד יתר;
- ניאופלזיה אנדוקרינית מרובה מסוג I עם היפרפאראתירואידיזם (תסמונת ורמר);
- ניאופלזיה אנדוקרינית מרובה מסוג II עם היפרפאראתירואידיזם (תסמונת סיפל).
- לפי מאפיינים קליניים:
- צורת העצם:
- אוסטאופורוטי,
- דלקת אוסטאיטיס פיברוציסטית,
- "פאגטואיד";
- צורה ויסקרופטית:
- עם נזק בולט לכליות, מערכת העיכול, תחום נוירופסיכיאטרי;
- צורה מעורבת.
- צורת העצם:
- בְּמוֹרַד הַזֶרֶם:
- חָרִיף;
- כְּרוֹנִי.
היפר-פאראתירואידיזם משני (תפקוד יתר משני והיפרפלזיה של בלוטות יותרת התריס עם היפוקלצמיה והיפרפוספטמיה ממושכות)
- פתולוגיה של הכליות:
- אי ספיקת כליות כרונית;
- טובולופתיה (סוג אלברייט-פאנקוני);
- רככת כלייתית.
- פתולוגיה של המעיים:
- תסמונת חוסר ספיגה.
- פתולוגיה של העצם:
- אוסטאומלציה סנילית;
- לידה;
- אידיופתי;
- מחלת פאג'ט.
- מחסור בוויטמין D:
- מחלת כליות;
- כָּבֵד;
- ליקויים אנזימים תורשתיים.
- מחלות ממאירות: מיאלומה.
היפרפאראתירואידיזם שלישוני
- אדנומה(ות) אוטונומית של בלוטת יותרת התריס, המתפתחת על רקע היפר-פאראתירואידיזם משני ארוך שנים.
פסאודו-היפר-פאראתירואידיזם
- ייצור הורמון פאראתירואיד על ידי גידולים ממקור שאינו פאראתירואיד.
תצורות ציסטיות וגידולים לא פעילות הורמונלית של בלוטות יותרת התריס
- כִּיס.
- גידולים או קרצינומה לא פעילים הורמונלית.
היפופאראתירואידיזם
- תת-התפתחות מולדת או היעדר בלוטות יותרת התריס.
- מקור אידיופתי, אוטואימוני.
- לאחר הניתוח, שפותח בקשר להסרת בלוטות יותרת התריס.
- לאחר הניתוח עקב פגיעה באספקת הדם ובעצבוב.
- נזקי קרינה, אקסוגניים ואנדוגניים (טיפול בקרינה חיצונית, טיפול במחלות בלוטת התריס באמצעות יוד רדיואקטיבי).
- נזק לבלוטות יותרת התריס עקב דימום או אוטם.
- נגעים זיהומיים.
פסאודו-היפופאראתירואידיזם
- סוג I - חוסר רגישות של איברי המטרה להורמון פאראתירואיד, התלוי באדנילט ציקלאז;
- סוג II - חוסר רגישות של איברי המטרה להורמון פרתירואיד, ללא תלות באדנילט ציקלאז, אולי ממקור אוטואימוני.
פסאודופסאודוהיפופאראתירואידיזם
נוכחות סימנים סומטיים של פסאודו-היפופאראתירואידיזם אצל קרובי משפחה בריאים במשפחות של חולים עם פסאודו-היפופאראתירואידיזם ללא הפרעות ביוכימיות אופייניות וללא טטניה.
 [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
[ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
Использованная литература

